Celda espectroelectroquímica SEC-C
La espectroelectroquímica (SEC) tiene por objeto investigar el mecanismo de reacción electroquímica y la estructura de la interfaz entre la solución electrolítica y el electrodo. Los notables avances en este campo y en la tecnología relacionada permiten aplicar la SEC en amplios ámbitos.
Actualmente la relación entre la absorbancia y el potencial para el sistema reversible o cuasi-reversible se elucida teóricamente, sobre cuya base el análisis de las características electroquímicas se hace posible para el sistema de otra manera difícil con sólo el resultado del voltamperograma. Un ejemplo típico es la enzima redox/ima citocromo c y el azul de metileno.

Aplicaciones:
- Control en tiempo real del cambio cromático por reacción redox
- Análisis de la transferencia de carga en la interfaz electrodo/líquido
- Medición espectrométrica de la proximidad/superficie de los electrodos
- Espectro de absorción del producto y del intermediario
- Parámetros: concentración, coeficiente de difusión y tiempo de vida

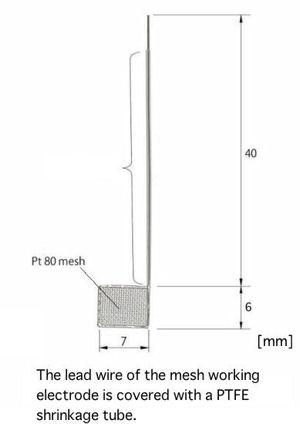
Electrodos de trabajo para la celda SEC-C
Los electrodos de trabajo pueden elegirse opcionalmente entre los que se indican a continuación:
| Catalog No. | Descripción |
ALS 012017 | SEC-C Electrodo de trabajo de malla de Au |
ALS 011498 | SEC-C Electrodo de trabajo de malla de Pt |
ALS 012607 | SEC-C05 Electrodo de trabajo de malla de Au |
ALS 012606 | SEC-C05 Electrodo de trabajo de malla de Pt |
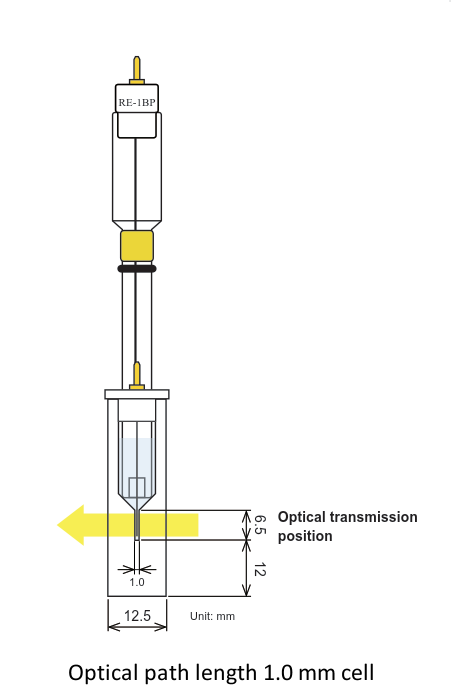
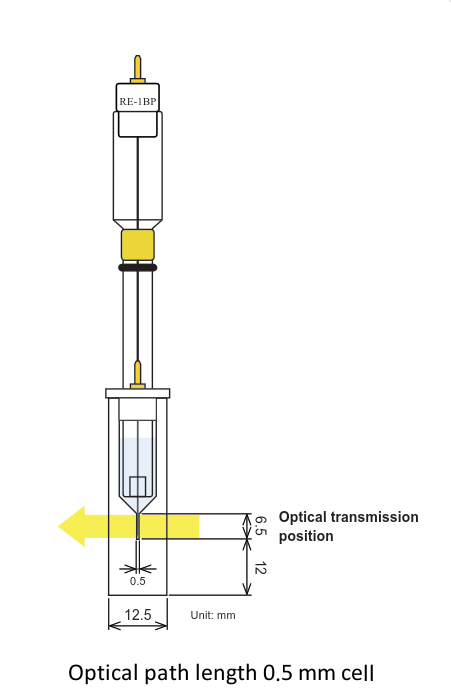
Dos opciones de longitud de camino óptico (0.5 y 1.0 mm)
Comparación de celdas de 0,5 y 1,0 mm de longitud de paso óptico
El tiempo de estabilización de la electrólisis para la célula de 0,5 mm de longitud de paso óptico es teóricamente la mitad, en comparación con la célula de 1,0 mm. Ocurre lo contrario para la concentración, cuando el mismo resultado para la célula de 1,0 mm es posible para la mitad de la concentración en comparación con la célula de 0,5 mm. Podría seleccionar la longitud del camino óptico y el electrodo de trabajo adecuados para su propósito de investigación.
| Longitud de camino óptico | Ventaja | Desventaja |
| 0.5 mm | Velocidad electrolítica mayor | Mayor mantenimiento |
| 1.0 mm | Menor mantenimiento | Velocidad electrolítica menor |
Comparación del tiempo de equilibrio de la reacción de electrólisis
En la comparación de las celdas de 0,5 y 1,0 de longitud de camino óptico, existe una diferencia entre los valores teóricos y experimentales. Esto es consecuencia de las condiciones experimentales.
Se sometió un ferrocianuro potásico 2 mM (K4[Fe(CN)6]) a una reacción de electrólisis a 0,6 V hasta su estabilidad, y se utilizó KNO3 1 M como referencia. La reacción de oxidación se monitorizó mediante la comparación de la absorbancia en función del tiempo a longitudes de onda de 420 y 300 nm.
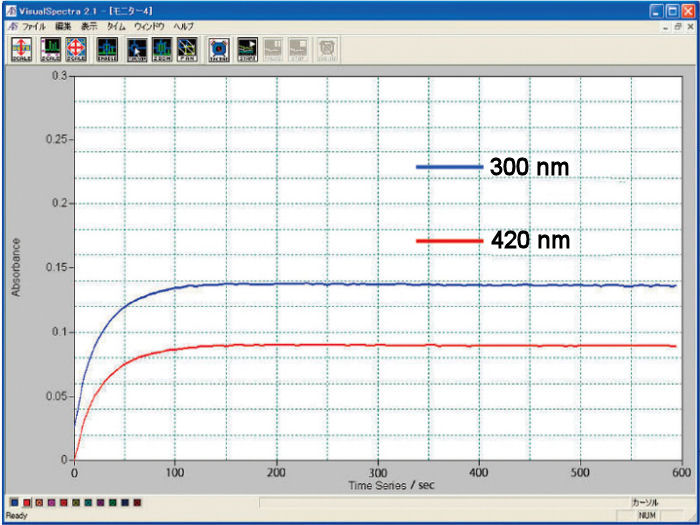
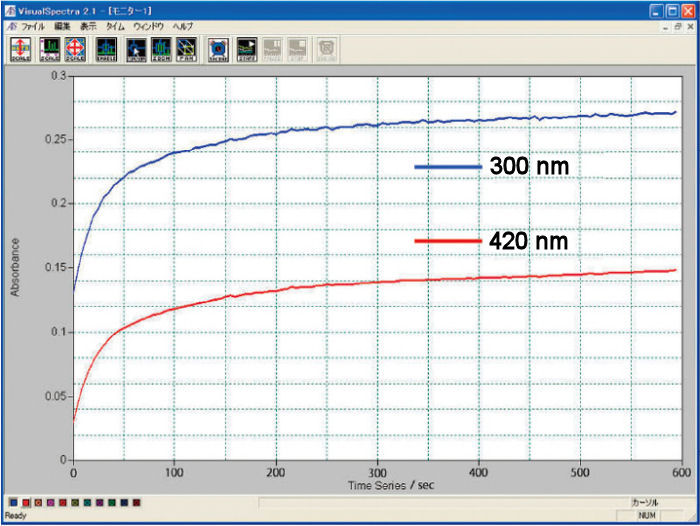
Medición con una celda espectroelectroquímica de tipo cubeta
Se midió el espectro de absorción UV-visible y la absorbancia del producto de la reacción del electrodo, realizada con electrodo ópticamente transparente (OTE). Como OTE se utilizó un electrodo de malla de oro o platino. A continuación se muestran la voltamperometría cíclica y la absorbancia del ferricianuro potásico 2 mM, como referencia de la absorbancia, realizadas en una célula espectroelectroquímica de vidrio de cuarzo de capa fina SEC-C.
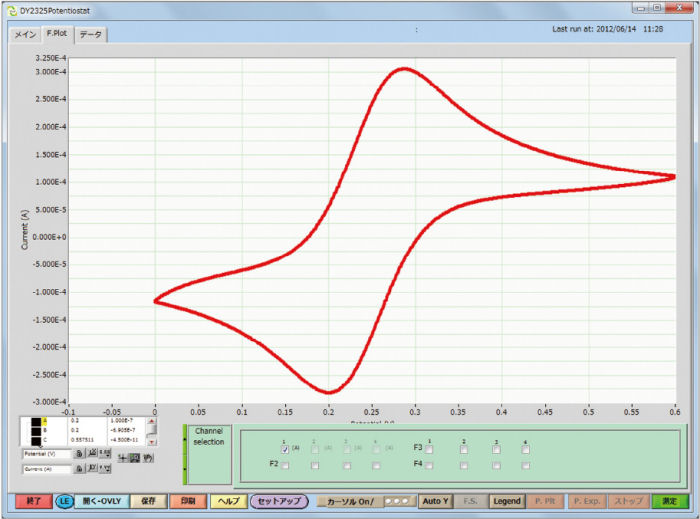
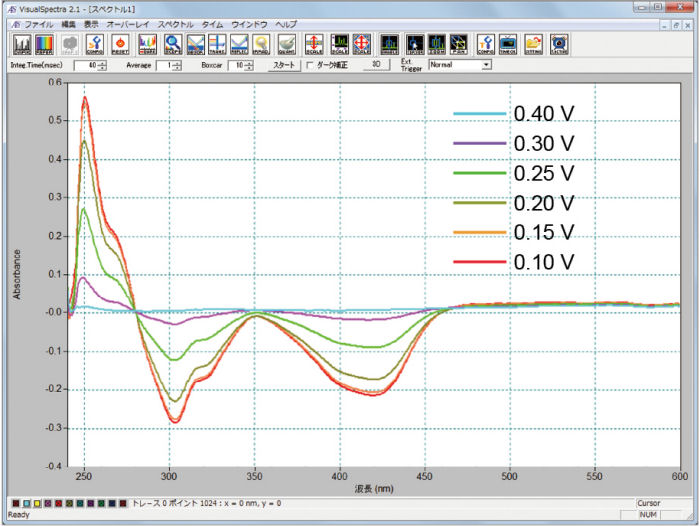
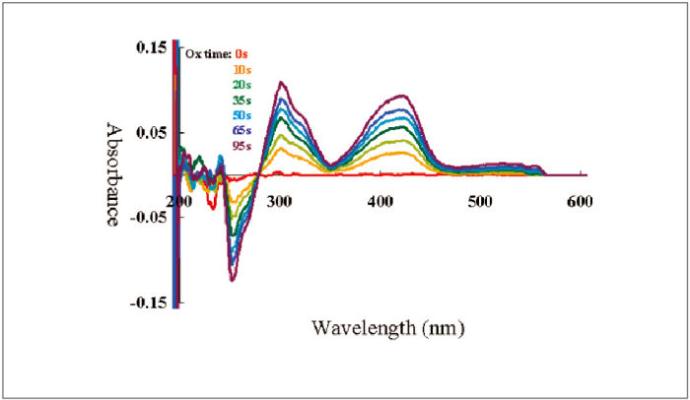
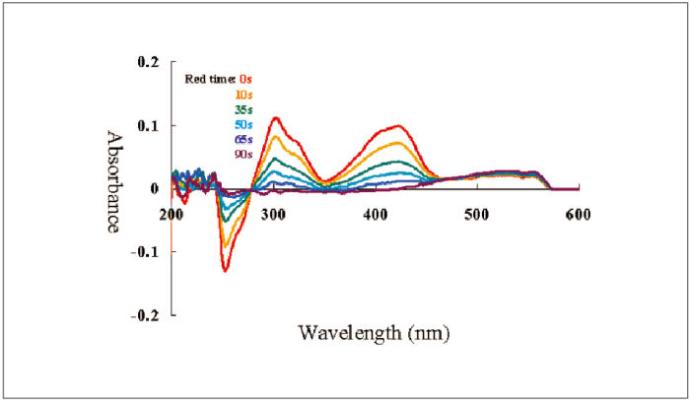
También se realizaron mediciones simultáneas de la voltamperometría cíclica y la absorbancia, así como una medición de la electrólisis a potencial constante. A continuación se muestra la electrólisis, reducción (Figura 3-1) y oxidación (Figura 3-2), de la solución de ferrocianuro potásico.