Electrodos de referencia

Linea completa de electrodos de referencia
Reference electrodes play an important role in the precision and reliability of electrochemical measurements. Discover the ideal reference electrode for your electrochemical measurements, biosensors or HPLC detectors, ensuring accuracy and reliability in your research.
Selección de Electrodo de Referencia
La referencia del potencial en la medición electroquímica se basa en el electrodo de referencia, por lo que es un electrodo muy importante.
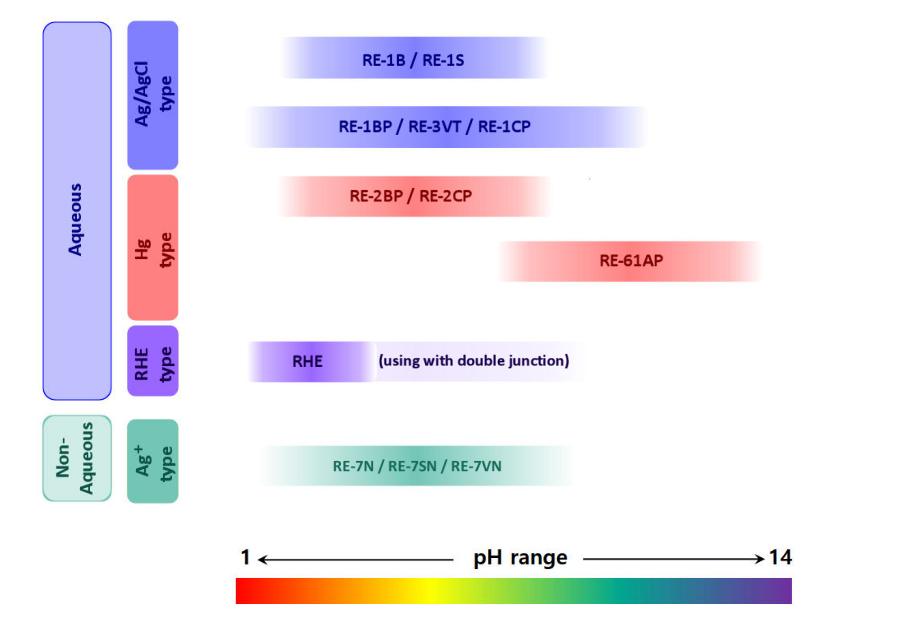
SFTec ofrece una amplia línea de electrodos de referencia que incluyen el electrodo de referencia para medición en solución acuosa, solución no acuosa, solución alcalina y electrodo de hidrógeno reversible. Además, los electrodos de referencia tienen el tamaño estándar, lo que hace posible que encajen en todos nuestros accesorios.
Para completar la gama, disponemos de electrodos de ALS tipo tornillo , que pueden utilizarse en: celdas de flujo cruzado, celdas de flujo radial, celdas de flujo EQCM y celdas de flujo SEC-Espectroelectroquímica.
Guía Sobre Electrodos de Referencia en la Investigación Electroquímica
Esta guía completa abarca los fundamentos de los electrodos de referencia, incluyendo tipos (Ag/AgCl, calomelano, Hg/HgO, etc.), usos, métodos de selección, cálculos de potencial y consideraciones clave, para aquellos nuevos en las mediciones electroquímicas.
Los electroquímicos confían en los electrodos de referencia para proporcionar una línea de base de potencial estable al controlar y medir los potenciales de los electrodos de trabajo. Este artículo explica cómo funcionan los electrodos de referencia, los tipos comunes, consideraciones de diseño y por qué permiten mediciones electroquímicas reproducibles.
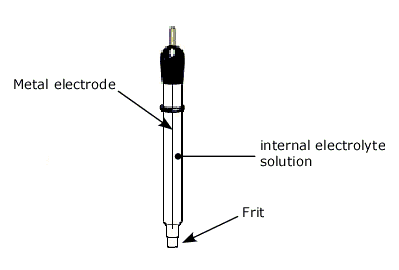
Un electrodo de referencia típicamente contiene un alambre de metal (Pt, Au, Hg, Ag, C, etc.), solución electrolítica interna y una unión porosa. Proporciona un potencial constante de media celda, permitiendo un control y medición precisos de los potenciales de los electrodos de trabajo en experimentos de electroquímica.
Los componentes clave de un electrodo de referencia son:
- Electrodo metálico - Platino, oro, plata, carbono, etc. Esto proporciona el potencial base.
- Electrolito interno - Contiene iones para establecer un equilibrio redox reversible en la superficie del metal.
- Fritz poroso - Hecha de cerámica, vidrio Vycor, etc. Permite el flujo de iones mientras separa los ambientes interno y externo.
Normalmente, se usa un pequeño tubo de vidrio (a veces teflón tubular para anticorrosión) como contenedor para estos tres componentes. El fritz se ubica al final del tubo para el contacto eléctrico con la solución de prueba. Se requiere que un electrodo de referencia tenga una estabilidad a largo plazo en la indicación constante del potencial. Para ello, no se debe permitir que la corriente eléctrica fluya a través del electrodo de referencia.
Dado que el flujo de corriente puede causar una deriva del potencial, se desea que un electrodo de referencia esté conectado a un circuito de alta impedancia. El potenciostato tiene un terminal de conexión para el electrodo de referencia que es un terminal de alta impedancia de entrada. Por lo tanto, el flujo de corriente a través del electrodo de referencia está estrictamente limitado.
También se utilizan electrodos de referencia a base de mercurio para algunas aplicaciones. Estos electrodos típicamente están alojados en un cuerpo sellado de vidrio o teflón resistente a la corrosión. El fritz poroso hace contacto con la solución de prueba.
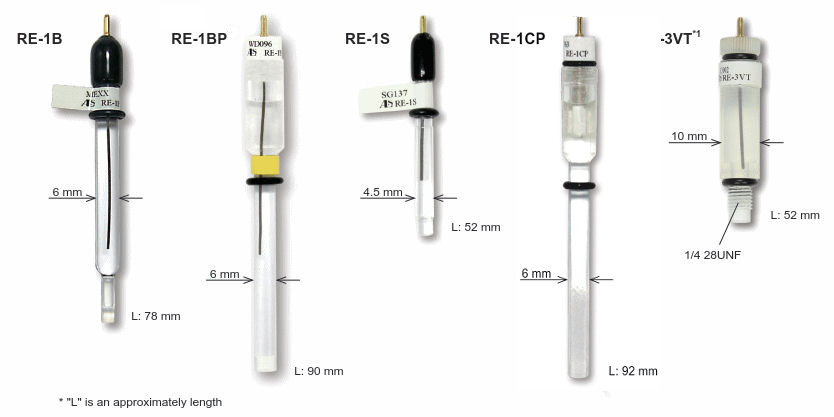
Los tipos esenciales de electrodos de referencia, como el calomelano saturado (SCE), el de plata - cloruro de plata (Ag/AgCl) y el electrodo de hidrógeno reversible (RHE), junto con las opciones a base de mercurio para aplicaciones específicas, resaltan la versatilidad y adaptabilidad de los electrodos de referencia a diversas necesidades de investigación.
Un electrodo de referencia ideal proporciona un potencial estable indefinidamente. Para lograr esto, el flujo de corriente a través de la celda debe minimizarse para prevenir la deriva del potencial. Por lo tanto, los electrodos de referencia están diseñados para tener alta impedancia.
La impedancia interna también debe ser baja para tiempos de respuesta rápidos del potenciostato. Se deben prevenir procesos físicos o químicos que aumenten la resistencia interna, como la obstrucción del fritz.
Asegurando la Estabilidad y Reproducibilidad en Mediciones Electroquímicas
Aunque conectar un alambre de platino sumergido en una solución de prueba al terminal de referencia de un potenciostato puede establecer contacto eléctrico, denominado pseudo electrodo de referencia, esta configuración por sí sola no garantiza la estabilidad o reproducibilidad de las mediciones de potencial. La verdadera reproducibilidad se logra únicamente integrando un electrodo de referencia fiable en la configuración experimental.
La impedancia interna de un electrodo de referencia idealmente es mínima para prevenir cualquier disminución en la tasa de respuesta o oscilaciones de potencial debido a alta impedancia en el bucle de retroalimentación. Esto subraya la necesidad de mantener el fritz al final del electrodo libre de depósitos que podrían aumentar significativamente la impedancia, potencialmente desestabilizando las mediciones.
El electrodo de hidrógeno estándar (SHE en inlgés) es un estándar primario de potencial, pero no necesariamente es conveniente para uso diario debido al manejo problemático del gas de hidrógeno. En lugar de SHE, como electrodos de referencia secundarios, el electrodo de calomelano saturado (SCE), el electrodo de plata - cloruro de plata (SSCE) y el electrodo de hidrógeno reversible (RHE), etc., son bien conocidos y utilizados.
¿Por qué un Electrodo de Referencia proporciona un potencial constante?
En el corazón de la capacidad de un electrodo de referencia para proporcionar un potencial constante está en el equilibrio redox reversible en la interfaz del electrodo, ejemplificado por reacciones como el electrodo de hidrógeno estándar (SHE), el electrodo de calomelano saturado (SCE) y el electrodo de plata - cloruro de plata (SSCE). Estas reacciones aseguran que un electrodo de referencia, manteniendo un par redox en equilibrio, ofrezca un potencial externo inalterable, clasificándolo como un electrodo no polarizable. En contraste, electrodos como el platino, oro y carbono, cuyos potenciales pueden ser ajustados externamente, se denominan electrodos polarizables y se utilizan como electrodos de trabajo o contraelectrodos (auxiliares).
La clave es el equilibrio redox reversible en la interfaz del electrodo, por ejemplo:
SHE H2 ⇔ 2H+ + 2e- (0V)
SCE Hg + Cl- ⇔ 1/2Hg2Cl2 + e- (+0.24V)
SSCE Ag + Cl- ⇔ AgCl + e- (+0.20V)
El electrodo, que puede consistir en un par redox en equilibrio, se llama electrodo de referencia. El potencial de un electrodo de referencia no puede ser cambiado externamente, por lo que se llama electrodo no polarizable. Por el contrario, el platino, oro y carbono, cuyos potenciales pueden ser cambiados externamente, se llaman electrodos polarizables y se utilizan como electrodos de trabajo o contraelectrodos (auxiliares).
Dado que los potenciales relativos entre los diversos electrodos de referencia son fijos y bien conocidos, tiene un significado importante que la comparación entre datos experimentales obtenidos incluso en diferentes lugares y tiempos sea posible si se especifica el electrodo de referencia utilizado.
Logrando el equilibrio del electrodo de referencia para electroquímica precisa
Los electrodos de referencia proporcionan la línea de base de potencial estable necesaria para controlar y medir los electrodos de trabajo en experimentos de electroquímica. Este artículo explica cómo funcionan los electrodos de referencia comunes de Ag/AgCl, los factores que impactan la estabilidad del potencial, el uso adecuado y las verificaciones de deriva de potencial.
Un electrodo de referencia ideal opera a corriente cero para mantener un potencial fijo indefinidamente. Los terminales de referencia en los potenciostatos cuentan con entradas de alta impedancia para prevenir el flujo de corriente a través de la celda. Sin esto, las fluctuaciones desplazarían el potencial de referencia y alterarían el control del electrodo de trabajo.
Electrodos de referencia de cloruro de plata-plata
El electrodo de referencia más popular en la actualidad es el de cloruro de plata-plata (SSCE). Ofrece mejor estabilidad que los antiguos diseños de calomelano sin mercurio tóxico. Se establece un equilibrio en la superficie de plata:
La reacción en el SSCE se muestra a continuación.
Ag + Cl- ⇔ AgCl + e- (E = +0.20V vs SHE)
La reacción hacia adelante es oxidación y la inversa es reducción. Estas reacciones están en equilibrio. El ion cloruro (Cl-) proviene de la solución electrolítica interna (KCl o NaCl). Ag es el propio alambre de plata. AgCl es una película sólida delgada formada en la superficie del alambre de plata.
Es fácil fabricar un electrodo Ag/AgCl. Solo se anodiza el alambre de plata limpio en una solución acuosa que contiene iones de cloruro (KCl o HCl, etc.). La película formada en la superficie del alambre es rosa pálido y se vuelve gris oscuro con el tiempo. El alambre obtenido así se coloca en una solución de KCl confinada en un tubo de vidrio con un frit en su extremo para el contacto eléctrico con la solución de prueba, como se muestra en la figura derecha. Eso es todo.
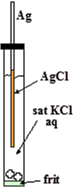
Reference electrode detailed
El potencial del electrodo de la reacción anterior se da como sigue.
E = E0Ag+ + (RT/F)ln aAg+ eq.(1)
La sustitución de la actividad del ion plata con la constante de producto de solubilidad de AgCl, KsAgCl da como resultado la ecuación (2).
E = E0Ag+ + (RT/F) ln KsAgCl - (RT/F) ln aCl- eq.(2)
Usando valores de la literatura de E0Ag+ y KsAgCl (E0Ag+=0.7991 V, y KsAgCl = [Ag+][Cl-] = 1.6×10-10), se obtiene la ecuación (3) bien conocida.
E = 0.222 - (RT/F) ln aCl- eq.(3)
aCl- es la actividad del ion cloruro en la solución interna del electrodo. Por lo tanto, el potencial de referencia del SSCE depende de la actividad del ion cloruro además de la temperatura. Un aumento de la actividad resulta en un cambio catódico del potencial. Por lo tanto, mantener constante la concentración interna de cloruro es importante para obtener resultados reproducibles.
El potencial de referencia del SSCE saturado (en solución saturada de KCl) es 0.197 V a 25°C versus el electrodo de hidrógeno estándar (SHE). El contacto eléctrico del electrodo de referencia con la solución de prueba se realiza a través del frit que permite la transferencia mutua entre la solución interna y la solución de prueba. Por lo tanto, la dilución de la solución interna y la contaminación de la solución de prueba pueden proporcionar problemas significativos a veces.
En lugar de KCl, a veces se elige NaCl como electrolito interno. Cuando un anión perclorato está involucrado en la solución de prueba, a menudo se emplea NaCl como electrolito interno debido a la baja solubilidad del perclorato de potasio en comparación con las sales de sodio. La deposición de perclorato de potasio dentro del frit puede causar problemas serios como un gran aumento de la impedancia del electrodo de referencia.
Una de las principales razones para usar KCl es que el catión potasio y el anión cloruro tienen una movilidad casi idéntica, por lo que el potencial de unión líquida en la interfaz líquida compuesta por estos iones se minimiza. Mientras, el potencial de unión líquida en el caso de usar NaCl como electrolito interno puede ser bastante considerable. Cuál es la mejor opción puede depender de un compromiso entre la conveniencia práctica.
Mantener constante la concentración de cloruro con electrolitos saturados de KCl o NaCl es clave para la reproducibilidad. La contaminación o difusión pueden alterar este equilibrio y cambiar el potencial de referencia. Prevenir la acumulación de material en el frit minimiza estos efectos. La relación de movilidad entre el catión y el anión también impacta los potenciales de unión líquida. A menudo se prefiere KCl sobre NaCl ya que el potasio y el cloruro tienen movilidades casi iguales. Sin embargo, NaCl puede usarse cuando se prueba con perclorato, que tiene menor solubilidad con el potasio que las sales de sodio.
El manejo del electrodo de referencia es importante, de lo contrario, resulta en un cambio del potencial de referencia. Entre usos, deben almacenarse en solución que coincida con el electrolito interno para evitar la contaminación. La punta del frit debe mantenerse limpia; los depósitos aumentan la impedancia, lo que ralentiza la respuesta del potenciostato.
Método de verificación del electrodo de referencia Ag/AgCl
Una verificación simple compara el potencial de membrana entre un electrodo de referencia existente y uno nuevo en solución de NaCl 3M o KCl saturado. La diferencia esperada es 0V ± 20mV si ambas celdas funcionan correctamente. Variaciones mayores indican deterioro que requiere reemplazo de la celda.
Potencial de referencia para diferentes tipos de electrodo de referencia.
NHE (Electrodo de Hidrógeno Normal)
| 0 mV |
| SCE (Electrodo de Calomel Saturado)
| 241mV |
SSCE (Electrodo de Calomel Saturado de Sodio)
| 236mV |
Ag/AgCl (NaCl Saturado)
| 201mV |
Ag/AgCl (KCl Saturado)
| 198mV |
Hg/HgSO4 (HgSO4 Saturado) | 616mV |
Cu/CuSO4 (CuSO4 Saturado)
| 300mV |
El electrodo de calomel saturado (SCE) se utilizó como el electrodo de referencia dominante durante décadas antes de que las preocupaciones ambientales sobre el mercurio. Este artículo revisa la estructura del SCE, las reacciones que determinan el potencial, las dependencias de concentración, los efectos de temperatura y las consideraciones de uso.
El SCE establece el equilibrio entre el metal de mercurio y el cloruro de mercurioso:
Hg + Cl- ⇔ 1/2Hg2Cl2 + e- (1)
El potencial se describe por la ecuación de Nernst con términos para el potencial redox del cloruro de mercurioso (E0), la constante de gas (R), la temperatura (T) y la actividad del cloruro (aCl-).
E = E0Hg22+/Hg + RT/2F ln Ks(Hg2Cl2) - RT/F ln aCl- (2)
Los primeros dos términos en el lado derecho de la ecuación (2) se reemplazan por E0Hg2Cl2/Hg que se calcula en 0.273V de los valores de literatura del potencial redox (E0Hg22+/Hg = 0.7960V) y la constante de producto de solubilidad (Ks(Hg2Cl2)=2×10-18).
Volviendo a reemplazar E0Hg2Cl2/Hg por E0, se obtiene la ecuación (3), que es una fórmula familiar que involucra la actividad del ion cloruro.
E = E0 - (RT/F) ln aCl- (3)
Aunque existe una pequeña discrepancia en el valor calculado anteriormente, se conoce que E0 es 0.268 V para el potencial estándar a 25°C. El potencial del electrodo depende de la concentración de ion cloruro como el electrodo de cloruro de plata-plata. Es 0.280 V en KCl 1M y 0.241 V en KCl saturado que se llama tan a menudo como SCE como abreviatura de Electrodo de Calomel Saturado.
El SCE tradicional presenta un cuerpo de vidrio lleno de pasta de Hg-Hg2Cl2 rodeando un reservorio de KCl. Un frit cerámico hace contacto con la solución de prueba. Los puentes de sal de brazo frágil se han reemplazado por pastas soportadas por cerámica más convenientes.
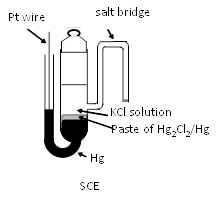
El potencial de referencia del SCE es 0.241 V (a 25°C), debido a la actividad aumentada del ion cloruro en la solución interna de KCl saturado (aprox. 4.8 M). Además de la dependencia de la concentración de cloruro del potencial, la dependencia de la temperatura del potencial es de aproximadamente -0.5 mV por grado. Excepto por el SCE, los potenciales de referencia son 0.280 V y 0.334 V para KCl 1 M y KCl 0.1 M, respectivamente. Cuanto mayor es la concentración de KCl, mayor es la dependencia de la temperatura del potencial.
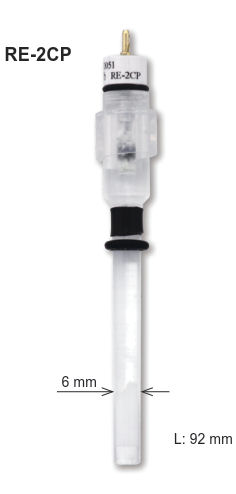
El brazo lateral como puente de sal extendido desde el cuerpo del SCE en la figura anterior no es conveniente para el uso diario debido a su fragilidad. Por lo tanto, el electrodo de mercurio se coloca en la parte superior y una pasta de cloruro de mercurio-mercurioso se coloca debajo de él y está soportado por cerámica, etc. Este tipo de electrodo SCE está disponible de BAS Inc. (RE-2BP como se muestra en la figura derecha).

A menudo recibimos la pregunta de "¿Es utilizable el SCE para experimentos en solvente orgánico?". La respuesta es "Sí". Sin embargo, en el caso de que no desees una contaminación con agua o ion cloruro, se recomienda usar un puente de sal, en el cual ambos, el mismo solvente orgánico y electrolito utilizado en tu solución de prueba, estén contenidos. Aun así, debes prestar atención al hecho de que un potencial de unión bastante grande entre el SCE y el puente de sal aún permanece desconocido. Además de eso, considerando un riesgo creciente de deposición en el frit, podría ser mejor usar un electrodo de referencia para solvente no acuoso (como Ag-Ag+ en solvente orgánico) o pseudo-electrodo de referencia (como alambre de Pt), y luego referirse al estándar interno como ferroceno.
El uso de pseudo-referencia solo conectando al terminal de referencia del potenciostato es recomendable desde el punto de vista de baja impedancia.
A pesar de alejarse de los electrodos de mercurio debido a preocupaciones ambientales, los SCE siguen siendo indispensables en la electroquímica moderna debido a su fiabilidad. Cuando se manejan correctamente, proporcionan la precisión necesaria para investigaciones de calidad.
Para la investigación electroquímica que requiere evitar la contaminación por iones de cloruro o implica soluciones fuertemente alcalinas o ácidas, seleccionar el electrodo de referencia adecuado es crucial. Los electrodos tradicionales de Ag/AgCl o calomel no siempre pueden ser adecuados. En tales casos, el electrodo de óxido de mercurio-mercurio (Hg-HgO) para entornos alcalinos y los electrodos de sulfato de mercurio-mercurioso para contextos neutros o ácidos ofrecen alternativas viables.
Electrodo de Referencia de Óxido de Mercurio-Mercurio para Soluciones Alcalinas (electrodo Hg-HgO)
Los electrodos de óxido de mercurio-mercurio utilizan el equilibrio entre el metal de mercurio y las capas de óxido/hidróxido de mercurio para proporcionar un potencial estable en soluciones fuertemente alcalinas hasta pH 14. La reacción de la celda es:
Hg ⇔ Hg2+ + 2e- (1)
HgO + H2O ⇔ Hg(OH)2 ⇔ Hg2+ + 2OH- (2)
El potencial del electrodo para la reacción (1) se muestra a continuación como la ecuación (3).
E= E0Hg/Hg2+ + (RT/2F) ln aHg2+ (3)
Dado que la actividad del ión mercurio se da usando la constante de producto de solubilidad como aHg2+ = Ks(Hg(OH)2) /(aOH-)2, la ecuación (3) se reemplaza por la ecuación (4).
E = E0Hg/Hg2+ + (RT/2F ) ln Ks(Hg(OH)2) - (RT/F ) ln aOH- (4)
Como se describe en la sección de cloruro de plata-plata, el potencial estándar del electrodo de referencia que utiliza sal altamente insoluble depende significativamente de su constante de producto de solubilidad.
Usando E0Hg/Hg2+ = 0.8537 y Ks(Hg(OH)2) ≃ 10-25, la ecuación (4) se da finalmente como a continuación.
E= 0.116 - (RT/F ) ln aOH- (5)
El potencial obedece la ecuación de Nernst que contiene términos para la actividad del ión mercurio y la concentración de hidróxido. Las soluciones de relleno internas comunes incluyen NaOH, KOH, soluciones saturadas de Ca(OH)2 y Ba(OH)2. Estas dos últimas tienen menor solubilidad para la compatibilidad con contenedores de vidrio.
Los potenciales estándar varían de +0.110V a +0.192V frente al electrodo estándar de hidrógeno (SHE), aumentando con la disminución de la actividad de hidróxido. Esto permite mediciones precisas en entornos que deterioran las celdas de Ag/AgCl o calomel.
Electrodo de sulfato de mercurio-mercurioso
De manera similar, los electrodos de sulfato de mercurio-mercurioso proporcionan un potencial reproducible de +0.612V para soluciones neutras o ácidas empleando la reacción:
Hg + 1/2SO42- ⇔ 1/2Hg2SO4 + e- (6)
E = E0Hg/Hg22+ + (RT/2F) ln aHg22+ (7)
La ecuación (7) se reemplaza utilizando la relación entre la actividad del ion mercurioso y la constante de producto de solubilidad Ks(Hg2SO4),
Ks(Hg2SO4) = [Hg22+][SO42-]) como sigue.
E = E0Hg/Hg22+ + (RT/2F ) ln Ks(Hg2SO4) - (RT /2F ) ln aSO42- (8)
Poniendo E0Hg/Hg22+ = 0.7960V(25°C) y Ks(Hg2SO4) ≃ 7×10-7, en la ecuación (8), la forma final se muestra a continuación.
E= 0.6125 - (RT/2F ) ln aSO42- (9)
El potencial de referencia es considerablemente positivo en comparación con el del electrodo de calomel, reflejando la bastante gran solubilidad del sulfato de mercurioso. K2SO4 saturado o 1 M H2SO4 se utilizan como el electrolito interno. Este diseño sin haluro evita la contaminación al probar en medios libres de cloro. Ofrece una alternativa a las células de calomel en entornos de bajo pH que dañan las referencias Ag/AgCl.
Los electrodos especializados de mercurio expanden el rango de trabajo de las mediciones electroanalíticas. Al aprovechar diferentes reacciones de equilibrio, permiten un control preciso del potencial y mediciones del electrodo de trabajo en medios agresivos de pH y sin haluro. Una línea de estos tipos de electrodos está disponible de ALS Japón como RE-61AP para el electrodo Hg-HgO y RE-2CP para el electrodo Hg-Hg2SO4.