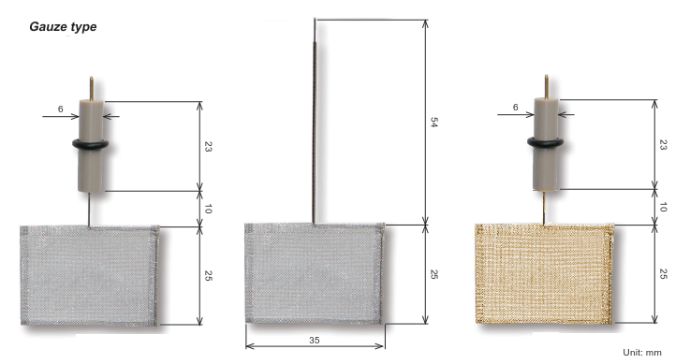
Working Electrodes

Optimiza tu Investigación Electroquímica
SFtec ofrece la más amplia selección de electrodos de trabajo para sus experimentos electroquímicos. Nuestros electrodos de trabajo se caracterizan por su diseño convencional, estabilidad química y características específicas que satisfacen las diferentes necesidades de detección. Desde electrodos convencionales como los de carbono vítreo hasta soluciones especializadas para la detección de analitos específicos, SFtec proporciona un amplio espectro de electrodos de trabajo para apoyar su investigación electroquímica al precio adecuado.
SFtec también ofrece soluciones personalizadas adaptadas a necesidades de investigación específicas. Ponte en contacto con nosotros si necesita ayuda para seleccionar el WE que mejor se adapte a tus necesidades o si buscas una solución personalizada.
Tipos de electrodos de trabajo
Notas Técnicas sobre Electrodos de Trabajo
Tipo de Electrodos de Trabajo | Funcionalidades y Aplicaciones |
Electrodo de platino (PTE) | Electrodo convencional, ideal para la detección de H2O2 y óxidos, este electrodo es conocido por su onda de adsorción de hidrógeno. |
Electrodo de oro (AUE) | Electrodo convencional, espléndido para la detección de tioles debido a su ausencia de onda de adsorción de hidrógeno. |
Electrodo de carbono vítreo (GCE) | Ofrece estabilidad química con grandes sobrepotenciales para evoluciones de oxígeno e hidrógeno, lo que lo hace versátil para numerosas pruebas. |
Electrodo de plata (AGE) | Especializado para la detección de cianuro y sulfuro debido a su naturaleza sensible. |
Electrodo de pasta de carbono (CPE) | Puede mezclarse con enzimas para crear electrodos modificados adecuados para fines analíticos específicos. |
Electrodo de níquel (NIE) | Modificado químicamente para la detección de aminoácidos, lo que demuestra su adaptabilidad. |
Electrodo de paladio (PDE) | Se utiliza para estudiar los procesos de adsorción y desorción de hidrógeno. |
Electrodo de carbono plastificado (PFCE) | Presenta un borde de grafito altamente orientado expuesto a la superficie, ofreciendo una alternativa rentable con características similares al HOPG. |
En esta guía, compartiremos información sobre cómo utilizar eficazmente electrodos de trabajo en configuraciones electroquímicas. Distinguir entre electrodos de trabajo y contraelectrodos en un sistema de dos electrodos puede ser desafiante; típicamente se identifican como ánodo o cátodo. Sin embargo, determinar las potenciales exactas del ánodo y del cátodo puede ser complejo, dejando incierta la ocurrencia de la reacción intencionada. Es crucial evaluar el potencial redox relacionado con la reacción deseada midiendo el potencial del electrodo de trabajo.
Una distinción clara entre el electrodo de trabajo y el contraelectrodo es alcanzable al usar un potenciómetro en una configuración de tres electrodos (como se observa en la imagen más abajo). Esta configuración permite la definición precisa del potencial del electrodo de trabajo contra un electrodo de referencia, mejorando la comprensión y control sobre el proceso electroquímico.
Mientras que conectar un alambre de platino inmerso en la solución de prueba al terminal de referencia del potenciómetro crea un electrodo de referencia pseudo, esta configuración puede no ofrecer mediciones de potencial estables o reproducibles. Lograr mediciones consistentes requiere el uso de un electrodo de referencia confiable.
A menudo surgen preguntas sobre la dinámica potencial del contraelectrodo. Esencialmente, el flujo de corriente a través del electrodo de trabajo es un espejo del contraelectrodo, diferenciándose solo en ser oxidativo o reductivo. Si al lado del contraelectrodo le falta material despolarizante suficiente en comparación con la reacción del lado del electrodo de trabajo, este desequilibrio podría conducir a un sobre potencial excesivo, potencialmente excediendo el voltaje de cumplimiento del sistema.
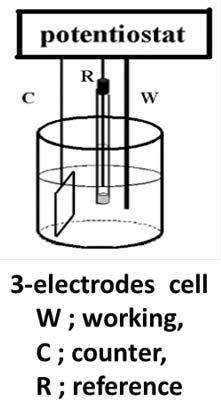
Abordar este desafío implica aumentar el área superficial del contraelectrodo para reducir la densidad de corriente. Este enfoque, que recomienda un contraelectrodo con un área superficial más grande que el electrodo de trabajo, es particularmente beneficioso para aplicaciones que requieren un flujo de corriente sustancial, como la electrólisis a granel, asegurando una operación más suave y minimizando posibles problemas.
Los electrodos se clasifican en dos tipos principales: polarizables y no polarizables. Los electrodos polarizables no permiten el flujo de corriente de Faraday cuando su potencial cambia, lo que los hace adecuados para su uso como electrodos de trabajo o contraelectrodos. Por otro lado, los electrodos no polarizables permiten el flujo de corriente de Faraday una vez que su potencial cambia, sirviendo típicamente como electrodos de referencia.
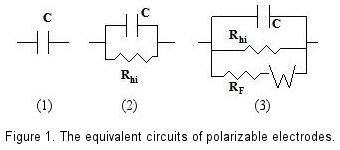
En modelos teóricos, un electrodo polarizable ideal se representa como un condensador en un circuito equivalente. Sin embargo, en la práctica, una corriente mínima sí fluye, requiriendo una resistencia de alto valor en paralelo con el condensador para representar con precisión un electrodo polarizable real.
Cuando una especie redox está presente junto a un electrodo polarizable, ocurre una reacción redox en la superficie del electrodo, induciendo corriente de Faraday en potenciales específicos. Esta situación requiere la inclusión de una resistencia variable dependiente del potencial, así como un elemento de Impedancia de Warburg para tener en cuenta los efectos de difusión de la especie, aumentando la complejidad del circuito equivalente. [Fig. 1-(3)]
El concepto de una ventana potencial surge en ausencia de un sistema redox, manteniendo el circuito de capacitancia y alta resistencia incluso cuando el potencial del electrodo cambia. Esta ventana es crucial para aplicaciones prácticas, con materiales como Platino, Oro y Carbono (por ejemplo, carbono vítreo) que típicamente ofrecen ventanas potenciales amplias.
Oro, Platino y Electrodos de Metal
El platino, un material de electrodo polarizable común, es notable por su estabilidad. Sin embargo, su uso en soluciones acuosas exige atención a la generación de hidrógeno y un proceso de adsorción de protones precedente. La oxidación en la superficie del platino puede llevar a una corriente de reducción, un fenómeno común en electrodos de metal sólido. Aún así, concentraciones bajas del componente objetivo pueden estrechar la ventana potencial debido a la interferencia de la corriente de fondo, aunque el rango de capacitancia teórica del electrodo determina principalmente esta ventana.
Históricamente, las convenciones de figuras como las representadas en la literatura antigua mostraban el potencial negativo en el lado derecho del eje potencial, reflejando la era en que la polarografía para la reducción de iones metálicos estaba muy extendida. Hoy en día, la convención de la IUPAC de mostrar el potencial positivo a la derecha es predominantemente utilizada.
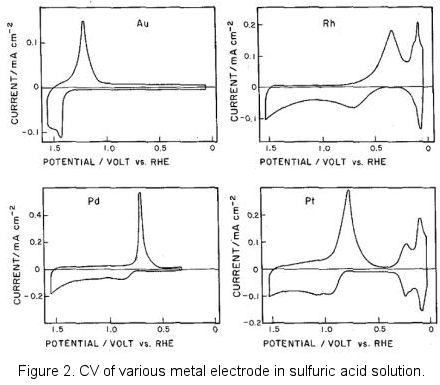
En contraste con las soluciones electrolíticas acuosas, los electrodos de platino exhiben un amplio rango de potencial en solventes orgánicos no protónicos sin la ocurrencia de reacciones de adsorción, desorción y evolución de hidrógeno. Sin embargo, es crucial notar que en soluciones acuosas con alta concentración de iones de cloruro, el platino puede disolverse debido a la formación de iones de ácido cloroplatínico en potenciales de oxidación altos.
El oro, otro material de electrodo comúnmente utilizado, se diferencia del platino, ya que no exhibe ondas de adsorción-desorción de protones. El sobrepotencial para la reducción de protones a hidrógeno es significativamente más alto en el oro que en el platino, resultando en una ventana potencial más amplia para el oro en la dirección reductiva en soluciones acuosas.
Como el platino, el oro también puede disolverse en soluciones acuosas con altas concentraciones de iones de cloruro debido a la formación de iones de ácido cloruro de oro en potenciales de oxidación altos. La superficie del oro puede ser fácilmente modificada químicamente por compuestos de tiol, lo que lo hace útil en varios campos de investigación.
El carbono, junto con el oro y el platino, viene en varias formas, incluyendo grafito, grafito pirolítico, grafito pirolítico altamente orientado (HOPG), carbono vítreo y electrodos de diamante dopado con boro. Entre estos, el carbono vítreo es el material de electrodo más comúnmente utilizado. Se esperan futuros artículos que profundicen en análisis detallados y modificaciones químicas de superficies de electrodos de carbono.
El mercurio metálico, líquido a temperatura ambiente, puede formar gotas que caen por un capilar debido a la gravedad, comúnmente utilizado como electrodo de mercurio gota a gota o como un electrodo de suspensión estacionario, conocido como electrodo de mercurio colgante. Esta aplicación clásica en polarografía ha hecho que los electrodos de mercurio sean fundamentales en el desarrollo de métodos de análisis de reducción electroquímica. La superficie lisa del mercurio permite la preparación de electrodos altamente reproducibles. Su gran sobrepotencial para la reducción de iones de hidrógeno lo hace adecuado para detectar varios metales pesados (Pb, Tl, In, Cd, Sn, Zn, Ni, Cu, Mn, Fe, Co, Sb, Mg, Ca, Sr, W, etc.). Sin embargo, debido a preocupaciones ambientales, el uso de mercurio, especialmente en Japón, enfrenta regulaciones estrictas.
Los electrodos de trabajo típicamente utilizados en mediciones electroquímicas han sido delineados, con la posibilidad de emplear otros tipos de electrodos para propósitos especializados. En la investigación de la corrosión, por ejemplo, se utilizan electrodos de hierro para mediciones de polarización de trama de Tafel, mientras que los electrodos de níquel y aleación de níquel-titanio se eligen para la detección selectiva de carbohidratos en soluciones alcalinas. La clave es que diversos materiales pueden servir como electrodos de trabajo en aplicaciones apropiadas, adaptadas a objetivos de investigación específicos.
El grafito, una forma cristalina del elemento carbono, presenta una estructura única que se asemeja a anillos de benceno condensados en un plano, formando un patrón hexagonal de panal que se superpone en capas conocidas como carbono sp2. Esta disposición se denomina plano basal, mientras que la superficie perpendicular se llama plano de borde, mostrando una apariencia estratificada.
En el grafito, existe una anisotropía distinta entre los planos basal y de borde, particularmente en términos de resistencia eléctrica y propiedades del electrodo. El plano basal exhibe una resistencia eléctrica más baja en comparación con el plano de borde, que presume una mayor conductividad debido a su orientación estructural única. Además, la capacitancia de la doble capa eléctrica en la superficie del electrodo varía, con la superficie del electrodo de plano basal mostrando una capacitancia de doble capa eléctrica reducida, destacando las características electroquímicas diversas del grafito.
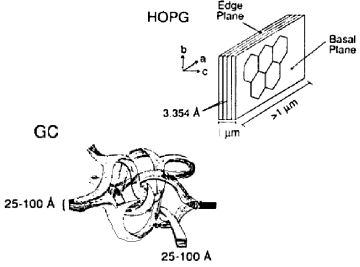
Fig.4-1 Esquema de la estructura del grafito y del carbono vítreo
- El grafito pirolítico (PG), producido a través de la descomposición a alta temperatura de gas hidrocarburo sobre un sustrato, puede lograr un orden cristalino mejorado bajo tratamiento adicional de alta temperatura y alta presión, resultando en grafito pirolítico altamente orientado (HOPG). El rendimiento del electrodo está estrechamente vinculado a su estructura cristalina, con la diferencia de potencial pico redox (ΔEp) sirviendo como un indicador de la ordenación superficial. Un ΔEp mayor a 700 mV sugiere una característica de plano basal de HOPG, en contraste con el ΔEp más pequeño típicamente observado en electrodos de grafito estándar. Esta diferencia subraya las tasas de transferencia de electrones más lentas en las superficies de HOPG.
- El carbono vítreo (GC), ampliamente utilizado como material de electrodo, muestra una estructura compleja donde tiras delgadas de grafito se entrelazan, formando lo que parece ser carbono amorfo vítreo a nivel macro. A pesar de su morfología ordenada microscópicamente, la estructura general del carbono vítreo se considera no cristalina, distinguiéndola de otros alotropos de carbono utilizados en materiales de electrodos. Los electrodos de carbono vítreo presentan una mezcla de planos basal y de borde, combinando las propiedades de ambos para ofrecer una superficie densa e impermeable ideal para aplicaciones electroquímicas.
- Además, los electrodos de pasta de carbono, creados mezclando polvo de grafito con aceite en una pasta, y los electrodos de fibra de carbono, diseñados para aplicaciones de microelectrodos, expanden el repertorio de materiales de electrodos basados en carbono. La introducción de boro en el diamante, creando electrodos
- Esta exploración del grafito y sus derivados subraya la versatilidad y adaptabilidad del material como material de electrodos, allanando el camino para la investigación y las aplicaciones electroquímicas avanzadas.